Первый закон Фарадея
В 1832 году Фарадей установил, что масса m (грамм) вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q (кулон), прошедшему через электролит:
, если через электролит пропускается в течение времени t (секунды) постоянный ток с силой тока I (ампер). Коэффициент пропорциональности  называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
 называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.Второй закон Фарадея
Электрохимические эквиваленты различных веществ пропорциональны их молярным массам и обратно пропорциональны числам, выражающим их химическую валентность.
Химическим эквивалентом иона называется отношение молярной массы A иона к его валентности z. Поэтому электрохимический эквивалент
где 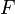 — постоянная Фарадея.
— постоянная Фарадея.
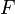 — постоянная Фарадея.
— постоянная Фарадея.
Второй закон Фарадея записывается в следующем виде:
где  — молярная масса данного вещества, образовавшегося г\моль;
— молярная масса данного вещества, образовавшегося г\моль;  — сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А;
— сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А;  — время, в течение которого проводился электролиз, с;
— время, в течение которого проводился электролиз, с; 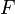 — постоянная Фарадея, Кл·моль−1;
— постоянная Фарадея, Кл·моль−1;  — число участвующих в процессе электронов.
— число участвующих в процессе электронов.
 — молярная масса данного вещества, образовавшегося г\моль;
— молярная масса данного вещества, образовавшегося г\моль;  — сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А;
— сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А;  — время, в течение которого проводился электролиз, с;
— время, в течение которого проводился электролиз, с; 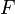 — постоянная Фарадея, Кл·моль−1;
— постоянная Фарадея, Кл·моль−1;  — число участвующих в процессе электронов.
— число участвующих в процессе электронов.


Комментариев нет:
Отправить комментарий